保姆级实验攻略!Trizol法提取RNA指南
发布时间:2025-11-09
浏览次数:7865
作者:东极药物
一、实验原理破膜-分层-沉淀-洗涤-溶解二、提取过程所需试剂1.TrizolTrizol的主要成分有苯酚、8-羟基喹啉、异硫氰酸胍、β-巯基乙醇。苯酚裂解细胞,释放出细胞内含物DNA、RNA、蛋白质等; 8-羟基喹啉破坏RNase的···
一、实验原理
破膜-分层-沉淀-洗涤-溶解
二、提取过程所需试剂
1.Trizol
Trizol的主要成分有苯酚、8-羟基喹啉、异硫氰酸胍、β-巯基乙醇。苯酚裂解细胞,释放出细胞内含物DNA、RNA、蛋白质等; 8-羟基喹啉破坏RNase的活性,保护RNA;异硫氰酸胍蛋白变性剂,可以和苯酚一起破坏细胞膜; β-巯基乙醇,抑制RNase的活性。
2.氯仿
氯仿即三氯甲烷,主要有两个作用,一个是变性蛋白质,一个是萃取,使水相和有机相的分离,RNA溶解于水相。在体系中加入Trizol和氯仿之后可以分为三层,下层是苯酚-氯仿相,上层是水相(含RNA),中间为蛋白相。
3.异丙醇
主要用于沉淀水相之中的RNA。
4.乙醇
洗涤作用,可以清洗RNA中的有机物杂质,如异丙醇,氯仿。并且乙醇挥发性较强,易于清理,从而得到纯净的RNA。
5.DEPC水
溶解RNA,DEPC水用二乙基碳酸酯(DEPC)处理过,去除了RNA酶污染。在溶解RNA的同时可以更好的保存RNA。
三、实验步骤
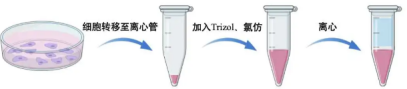
【注意】提RNA前务必清理台面,用酒精多喷几遍!!
1. 将细胞转移至离心管:消化细胞之后用适量培养基或者PBS重悬细胞,将细胞悬液转移到离心管中,离心之后弃上清液,沉淀中为细胞。
2. 加入Trizol和氯仿:在离心管中按照5:1的比例加入Trizol和氯仿,一般情况下每管加入500ul Trizol和100ul氯仿。加完之后剧烈震荡15s,一定要剧烈震动,可以用两个离心管架像奥利奥一样夹住离心管【奥(离心管架)-利(离心管)-奥(离心管架)】,然后像摇骰子一样剧烈的摇晃。一定要剧烈!
3. 静置离心:静置3min,然后离心12000rpm,4℃,离心10~15min。离心之后样品分成三层,上层是无色的水相,中间层是自色的,下层是粉红色的有机相。RNA主要是在水相中。
4. 加入异丙醇:把水相转移到干净的离心管中,加入等体积的异丙醇。比如500ul的水相加入500ul的异丙醇,混匀后室温静置20min左右。
5. 离心:离心12000rpm,4℃,离心10min,离心管底部会有白色沉淀,小心吸弃上清液
6. 75%乙醇洗涤:每管加入1m175%乙醇对沉淀进行洗涤,可以颠倒混匀几次充分洗涤。酒精必须现用现配!
7. 离心,小心弃去上清液,注意不要吸走RNA沉淀。
8. 敞开离心管的盖子,晾干RNA之后,加入适量的DEPC水在55℃溶解。
9. 测浓度。
四、核酸提取浓度检测解读
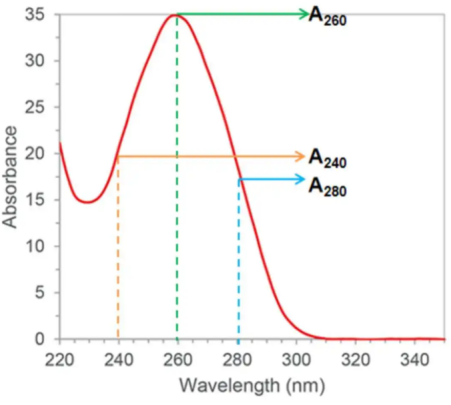
1. A260:核酸的主要吸收峰
【意义】核酸(包括DNA和RNA)在260nm波长处有最大吸收峰。
【用途】用来估算核酸浓度。
核酸浓度(μg/mL)=A260 x 稀释倍数 x 系数
DNA的系数为 50μg/mL·OD
RNA的系数为40 ug/mL·OD
核酸浓度的精确度受到杂质(如蛋白质或化学物质)的影响,需要结合比值来评估纯度。
2. A280:蛋自质的吸收峰
【意义】蛋白质在280nm波长处有显著吸收,主要由色氨酸和酪氨酸残基决定。
【用途】通过检测核酸样品中280nm的吸收值,可以判断样品是否有蛋白质污染。
3. A230:化学污染的敏感指示
【意义】230nm附近的吸收主要来源于有机物、盐类和试剂残留(如苯酚、胍盐)。
【用途】检测样品是否受到化学污染。
4. 比值解读-A260/A280
【理想值】纯DNA的A260/A280比值约为1.8;纯RNA的A260/A280比值约为2.0。
【偏低】可能有蛋白质污染。
【偏高】可能有RNA或其他杂质混入。
5. 比值解读-A260/A230
【理想值】通常为2.0~2.2。
【偏低】可能有盐类、胍盐、苯酚等化学污染。
【偏高】可能是检测误差或样品稀释过度。
PS.以上比值并不绝对,试剂厂家对比值范围有不同的解读:
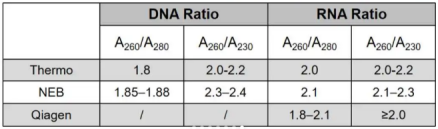
6. 检测数据的综合解读
A260/A280和A260/A230的意义:A260/A280比值主要反映蛋自质污染;A260/A230比值主要反映化学物质污染。
文章出自:验外实包 想了解更多请关注:http://www.dj-cro.com/























